Testes para Covid-19 rejeitados pela Anvisa são o dobro verificado em similares antes da pandemia
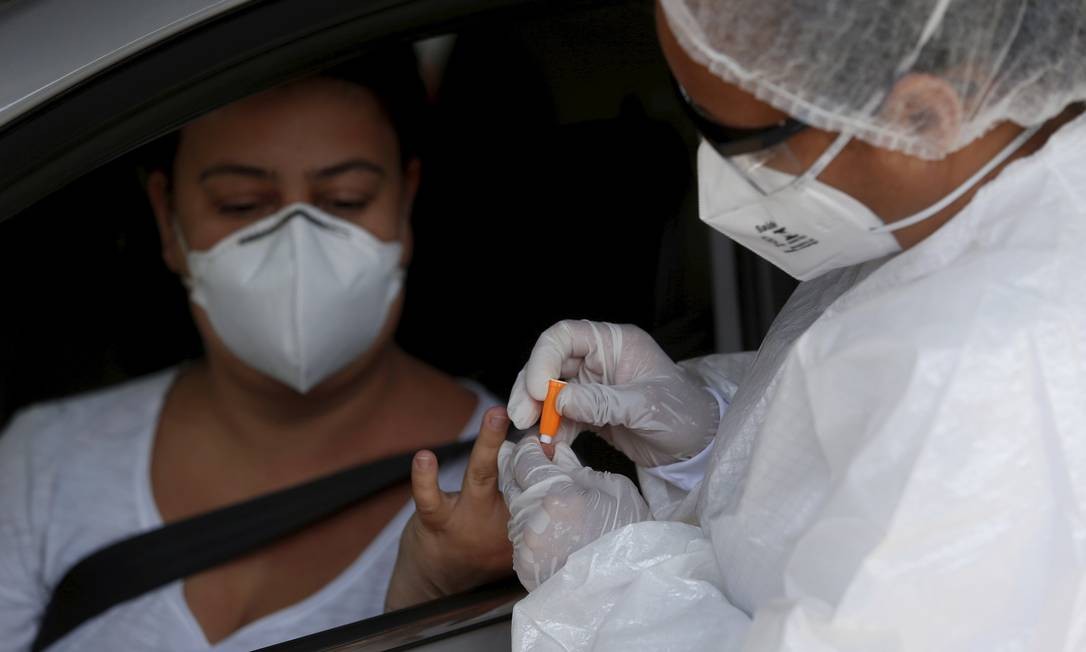
BRASÍLIA — A quantidade de testes para Covid-19 com registros rejeitados pela Agência Nacional de Vigilância Sanitária (Anvisa) é mais do que o dobro, em termos proporcionais, do universo de testes e reagentes em geral indeferidos pelo órgão no primeiro trimestre deste ano.
O indicador é uma amostra da baixa qualidade de produtos que inundaram o mercado brasileiro na pandemia, vindos de países como China e Coreia do Sul, principalmente os testes rápidos, que detectam em minutos a presença de anticorpos no organismo.
De 638 pedidos de registro de testes para a detecção do novo coronavírus, 112 foram indeferidos pela Anvisa. Isto representa 17,5% do total. O balanço da produtividade do órgão mostra que, no primeiro trimestre do ano, a área responsável por analisar testes e reagentes indeferiu 8,5% dos pedidos de registros.
A proporção de testes para Covid-19 sem registro é ainda maior do que o universo de produtos com indeferimentos dos processos. Ao todo, 40% dos testes seguem sem a validação da agência. Isto porque, além dos indeferimentos, há os casos em que segue em aberto a necessidade de cumprimento de exigências (116, ou 18%) e também aqueles com pendências na certificação de boas práticas de fabricação (16, ou 2,5%), além de outras razões. A reportagem utilizou os dados atualizados até a última quinta-feira, 10.
Principais motivos para indeferimentos são falta de documentação e habilitação de empresas
A Anvisa mantém esses dados públicos, com atualização diária, o que permite um acompanhamento das informações por qualquer cidadão. Uma parte expressiva desses testes foi distribuída para uso pela população, como O GLOBO revelou em reportagem publicada no último dia 4.
Mesmo sem registro, o teste "Biomol Onestep Covid-19", do tipo RT-PCR (molecular, com detecção de partículas do vírus), foi fabricado e distribuído pelo Instituto de Biologia Molecular do Paraná (IBMP), dentro de um contrato de R$ 208 milhões assinado com a Fundação Oswaldo Cruz (Fiocruz). Foram entregues 2,2 milhões de testes ao Ministério da Saúde, que, até a semana passada, já havia distribuído 1,93 milhão desses kits. A Anvisa investiga a fabricação e a distribuição do produto.
Em um "perguntas e respostas" sobre testes atualizado periodicamente à população, a Anvisa deixa claro: esses dispositivos precisam de registro da agência.
"Uma das etapas do controle sanitário de produtos é o registro junto à Anvisa. O objetivo é avaliar se o produto é capaz de dar o resultado para o qual foi desenvolvido", afirma no "perguntas e respostas". Os chamados testes "in house", desenvolvidos por laboratórios clínicos, só podem ser usados pelo laboratório que os produziu, em pesquisa ou apoio diagnóstico, e sem possibilidade de comercialização.
Os principais motivos para indeferimentos de registros são a falta de documentação e habilitação de empresas para fabricar ou importar os testes; a falta do certificado de boas práticas de fabricação; ou uma "instrução processual precária", que "inviabiliza a avaliação de segurança e eficácia dos produtos devido à ausência de informações", segundo a Anvisa.
"A situação de emergência em saúde pública decorrente da pandemia levou muitas empresas que nunca atuaram no segmento de produtos para diagnóstico in vitro a pleitearem a obtenção de registro para comercialização de produtos no Brasil, representando uma demanda sem precedentes para a Anvisa nos últimos meses. Não há registro de volume equivalente de pedidos avaliados por esta agência em um mesmo período", diz o órgão, por meio da assessoria de imprensa.
Os pedidos são avaliados em 15 dias, segundo a agência.
Testes para Covid-19 são classificados como de risco médio ou alto para as pessoas e a saúde pública, "passíveis de registro e destinados ao uso profissional", conforme a Anvisa. "Os requerentes precisam demonstrar como foram realizados os testes de desempenho e a qualificação das amostras utilizadas, além de evidências clínicas, considerando o tipo de produto, a indicação de uso e a metodologia empregada."
É comum que uma mesma empresa, a partir de importações ou intenções de compras no exterior, faça mais de um pedido de registro. Parte é deferida e parte não é deferida pela Anvisa, o que leva essas empresas a comprarem testes de outros empreendimentos no Brasil, que já tiveram êxito na importação e no registro dos testes. O produto, então, é vendido a prefeituras, governos estaduais e órgãos federais.
Um exemplo nesse sentido é o da empresa JKL Investimentos S.A., que ingressou em 7 de agosto com um pedido de registro de um teste rápido. A fase do pedido é "em exigência", conforme o sistema público da Anvisa. A empresa, para fornecer testes a municípios, comprou lotes de um teste sul-coreano importado por uma segunda empresa, a DFL Indústria e Comércio. Este teste tem registro desde abril.
A Vida Biotecnologia Ltda., por sua vez, entrou com pedidos de registro de quatro testes rápidos até setembro; dois foram deferidos. A empresa forneceu testes com registro a cidades do Maranhão e Goiás. Já a Lang e Filhos Material Hospitalar Ltda. importou um teste chinês e obteve registro da Anvisa em maio. O produto foi vendido para a Marinha e para o Hospital Federal de Ipanema. A empresa tenta o registro de um segundo teste rápido, "em exigência" desde abril.
Prefeituras, governos estaduais e órgãos públicos federais costumam exigir, já na fase dos editais para seleção e contratação, que uma empresa fabricante ou distribuidora de testes para Covid-19 apresente o registro do produto na Anvisa. Eles temem questionamentos jurídicos e de saúde pública se comprarem um produto sem a validação do órgão de vigilância sanitária.
O governo federal falhou na política de testagem em massa da população mais exposta ao novo coronavírus. O país atravessou a fase crítica da pandemia no escuro, sem testes suficientes para detectar infectados e para orientar isolamentos específicos de pessoas que tiveram contato com esses infectados.
Ainda no começo da pandemia, o Ministério da Saúde chegou a prometer 23 milhões de testes. Um mês e meio depois, dobrou a meta, com promessa de 46 milhões de testes. O painel de informações atualizado pela pasta mostra a distribuição de 8 milhões de testes rápidos e de 6,5 milhões do tipo RT-PCR. São 14,5 milhões no total, menos de um terço do prometido.
Fonte: Vinicius Sassine/O Globo












/i.s3.glbimg.com/v1/AUTH_59edd422c0c84a879bd37670ae4f538a/internal_photos/bs/2021/e/U/PuZeYfTD69TxKKOhdGLg/lider.png)


/i.s3.glbimg.com/v1/AUTH_59edd422c0c84a879bd37670ae4f538a/internal_photos/bs/2021/5/3/r1sjdbRJ6TmA5ZiwqOeg/caixa-economica-federal0505202673-840x472.jpg)









/i.s3.glbimg.com/v1/AUTH_bc8228b6673f488aa253bbcb03c80ec5/internal_photos/bs/2021/1/4/uQCxCrRxCEx0xVlGGitg/51271276780-085a9e3fd5-o.jpg)





/i.s3.glbimg.com/v1/AUTH_59edd422c0c84a879bd37670ae4f538a/internal_photos/bs/2025/o/Z/nWq6aQSHuM4DFetNJNRA/whatsapp-image-2025-10-17-at-14.08.04.png)

